Eurofarma trae a Latinoamérica el medicamento que reduce en 65 % crisis epilépticas refractarias
Cenobamato presentó resultados de eficacia nunca antes vistos en la industria farmacéutica y es resultado de alianza con la coreana SK Biopharmaceuticals
São Paulo, julio 2022 - Eurofarma, farmacéutica con presencia global en más de 20 países y la que más invierte en innovación en Brasil, trae a Latinoamérica un medicamento innovador enfocado en el tratamiento de la epilepsia focal/parcial refractaria en adultos. El cenobamato, con alianza de licencia con la coreana SK Biopharmaceuticals, es un marco en la historia de la Medicina, ya que reduce, para todos los pacientes que tienen la condición, un 65% en promedio el número de crisis epilépticas.1
Este índice de eficacia es sin precedentes, considerando a todos los productos ya lanzados desde que el primer anticonvulsivo llegó al mercado hace décadas.2 El medicamento ya cuenta con la aprobación de la FDA y EMA, agencias regulatorias americana y europea, respectivamente.
«Estamos muy felices por la alianza con SK Biopharmaceuticals. Este acuerdo refuerza nuestros planes de continuar expandiendo los negocios en todo el mundo, siempre de forma innovadora. Con el cenobamato, nuestro amplio portafolio de medicamentos para el sistema nervioso central estará todavía más fortalecido, proporcionando ahora la opción más eficaz entre todas las existentes en el mercado para médicos y sus pacientes», afirma Martha Penna, vicepresidente de Innovación de Eurofarma.
«Estamos extremadamente satisfechos con la alianza con Eurofarma, que tiene un historial comprobado en la región y una amplia red para impulsar el desarrollo y la comercialización de cenobamato en América Latina. Esta alianza reafirma nuestro compromiso de ofrecer tratamientos innovadores para personas con epilepsia en esta región. Continuaremos ampliando nuestra presencia en todo el mundo para apoyar la comunidad de pacientes y maximizar el valor del cenobamato», comenta Jeong Woo Cho, PhD, presidente y CEO de SK Biopharmaceuticals.
Eficacia e innovación
El lanzamiento de cenobamato refuerza la vena innovadora de Eurofarma en cerrar alianzas para productos que sean realmente innovadores. El medicamento es el primero de su clase en traerse a Latinoamérica, un fármaco con mecanismo de acción innovador aún no existente en el mercado y que trae un aumento de la eficacia nunca visto en las clases precedentes de anticonvulsivos. El mismo está dirigido a pacientes que tienen epilepsia focal refractaria, esto es, un tipo específico de la patología que es altamente resistente a los anticonvulsivos convencionales.
Pacientes con epilepsia focal no controlada presentan mala calidad de vida, mayor comorbilidad (por ejemplo, depresión, neumonías, enfermedades vasculares, osteoporosis y fracturas), declinación cognitivo/intelectual, mayores costos en los cuidados de la salud y con mayor riesgo de lesiones y muerte prematura, incluyendo un riesgo tres veces mayor de muerte que la población general (por estado de mal epiléptico, lesiones y muerte súbita inesperada en la epilepsia.3–9
En los estudios clínicos realizados en pacientes que sufren esta patología, los índices de eficacia fueron los mejores ya vistos entre todos los productos ya lanzados de forma global. Los pacientes tratados con la dosis de 400 mg/día tuvieron una reducción mediana del 65 %1 en la frecuencia de sus crisis convulsivas, con una reducción en torno del 56c% en los dos estudios que evaluaron la dosis de 200 mg/día1,10. Por otra parte, del total de pacientes en los estudios de eficacia, entre el 21 %1 y el 28,3 %10 no registraron ni siquiera una crisis epiléptica después de la inserción del medicamento en su rutina. Este segundo índice es muy superior a los resultados alcanzados por los productos convencionales, ya que, luego del tercer tentativo, solo el 4 % de pacientes tendrán reducción total de crisis convulsivas.11
Para este tipo de epilepsia, justamente por su perfil resistente a las medicaciones convencionales, muchas veces son considerados en el tratamiento dos o más fármacos para combatir a las convulsiones. Sin embargo, esta combinación también termina ampliando los efectos adversos sedativos, dejando a los pacientes más somnolientos y con disminución de su actividad productiva, perjudicando incluso su calidad de vida en el día a día.
En un estudio con seguimiento mediano de más de 6 años de tratamiento, se observó que la mitad de los pacientes dejó de usar una o más de las drogas convencionales que estaba usando. Entre estos pacientes, el 76 % continuaban beneficiándose con el uso del cenobamato al final del estudio, mostrando la buena tolerancia al medicamento.12 En su posología, el producto es de fácil manejo, ya que exige una única dosis diaria para el control de los síntomas.
Epidemiología
La epilepsia es una de las enfermedades neurológicas graves más comunes, afectando cerca de 68 millones de personas en todo el mundo13, y se caracteriza por la actividad anormal de las células cerebrales. Las crisis epilépticas causadas por alteración transitoria de las actividades neuronales pueden manifestarse de formas diferentes, siendo la más conocida de ellas la convulsión, pero también siendo recurrentes la alteración sensorial (sentir olor, ver luces), de percepción (sensación de ya haber visto algo - déjà vu -, sentimiento de miedo) y comportamentales (ausencia, mover las manos sin un propósito).
Un estudio enfocado en América Latina analizó 35 estudios de 11 países diferentes, estimando la prevalencia de epilepsia activa en torno del 1,24 % de la población,14 y estimando que cerca de 30 % de los pacientes con epilepsia focal/parcial sean refractarios,11,15 o sea, continúan teniendo crisis, sin remisión, a pesar del tratamiento adecuado con diferentes medicamentos anticonvulsivos. Es justamente en este punto que el cenobamato entra para hacer la diferencia, pudiendo reducir en el 65 %, en promedio, la frecuencia de crisis epilépticas en un potencial de más de 8 millones de personas en la región, mejorando exponencialmente su calidad de vida.
Alianza
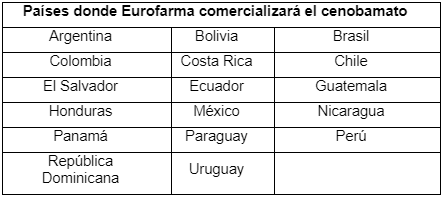
En los términos del acuerdo con SK Biopharmaceuticals, Eurofarma tendrá la exclusividad para desarrollar, fabricar y comercializar el cenobamato en todos los países de Latinoamérica listados a continuación. En retorno, la farmacéutica coreana recibirá un pago anticipado y podrá recibir marcos futuros y royalties sobre las ventas netas generadas.
El cenobamato, bajo los nombres comerciales de Ontozry® y Xcopri®, ya está en los mercados europeo y americano, respectivamente, siendo que en los Estados Unidos el producto ya cuenta con ventas que comenzaron recientemente. En ambas regiones, por la alta eficacia del medicamento y calidad inculcada, tanto la FDA como la EMA, órganos reguladores locales y dos de los de más credibilidad global, aprobaron rápidamente su inserción en el mercado.
En Brasil y demás países latinoamericanos, la expectativa es que el producto esté disponible para compra en 2025*.
*Actualización en febrero de 2025: se espera que el producto esté disponible en 2026.
Sobre el Grupo Eurofarma
Desde su fundación, en 1972, Eurofarma actúa en el sector de la salud, produciendo y comercializando productos y servicios para mejorar la calidad de vida de las personas. Enfocada en la generación de valor compartido, actúa en las áreas de Prescripción Médica, OTC, Genéricos, Hospitalarios y Oncología. Ofrece más de 700 productos, más de 2 mil SKUs y atiende 42 especialidades médicas. En Brasil, cubre 100 clases terapéuticas, que representan 70 % de las prescripciones en todo el mercado.
Presente en 20 países, con parque fabril en Brasil y plantas en otros seis países de Latinoamérica, generó en 2021 ventas netas por R$ 7,1 mil millones, un crecimiento del 23 % con relación al año anterior, y emplea a más de 8,1 mil personas.
Sobre SK Biopharmaceuticals
SK Biopharmaceuticals y su subsidiaria norteamericana SK life science son empresas farmacéuticas globales enfocadas en la investigación, desarrollo y comercialización de tratamientos para disturbios del sistema nervioso central (SNC). Las empresas tienen un pipeline de ocho compuestos en desarrollo para el tratamiento de disturbios del SNC, incluyendo epilepsia. Además de esto, SK Biopharmaceuticals está enfocada en investigaciones iniciales en oncología. Para obtener más informaciones, visite el sitio de SK Biopharmaceuticals en www.skbp.com/eng y el sitio de SK life science en www.SKLifeScienceInc.com.
Eurofarma en las redes sociales
Facebook: @eurofarma | LinkedIn: @eurofarma
Instagram: @eurofarma | Twitter: @eurofarma
Youtube: @eurofarmalab
Informaciones para Prensa
G&A – Relaciones Públicas
Carolina Carone - +55 11 98578-1604 - carolina.carone@gaspar.com.br
Guilherme Gaspar - +55 11 98285-6000 - guilherme@gaspar.com.br
Referencias:
1. Krauss, G. L. et al. Safety and efficacy of adjunctive cenobamate (YKP3089) in patients with uncontrolled focal seizures: a multicentre, double-blind, randomised, placebo-controlled, dose-response trial. Lancet Neurol. 19, 38–48 (2020).
2. Vossler, D. G. Remarkably High Efficacy of Cenobamate in Adults With Focal-Onset Seizures: A Double-Blind, Randomized, Placebo-Controlled Trial. Epilepsy Curr. 20, 85–87 (2020).
3. Lawn, N. D., Bamlet, W. R., Radhakrishnan, K., O’Brien, P. C. & So, E. L. Injuries due to seizures in persons with epilepsy: a population-based study. Neurology 63, 1565–1570 (2004).
4. Vingerhoets, G. Cognitive effects of seizures. Seizure 15, 221–226 (2006).
5. Taylor, R. S., Sander, J. W., Taylor, R. J. & Baker, G. A. Predictors of health-related quality of life and costs in adults with epilepsy: a systematic review. Epilepsia 52, 2168–2180 (2011).
6. Nevalainen, O. et al. Epilepsy-related clinical characteristics and mortality: a systematic review and meta-analysis. Neurology 83, 1968–1977 (2014).
7. Laxer, K. D. et al. The consequences of refractory epilepsy and its treatment. Epilepsy Behav. EB 37, 59–70 (2014).
8. Thurman, D. J. et al. The burden of premature mortality of epilepsy in high-income countries: A systematic review from the Mortality Task Force of the International League Against Epilepsy. Epilepsia 58, 17–26 (2017).
9. Baranowski, C. J. The quality of life of older adults with epilepsy: A systematic review. Seizure 60, 190–197 (2018).
10. Chung, S. S. et al. Randomized phase 2 study of adjunctive cenobamate in patients with uncontrolled focal seizures. Neurology 94, e2311–e2322 (2020).
11. Chen, Z., Brodie, M. J., Liew, D. & Kwan, P. Treatment Outcomes in Patients With Newly Diagnosed Epilepsy Treated With Established and New Antiepileptic Drugs: A 30-Year Longitudinal Cohort Study. JAMA Neurol. 75, 279–286 (2018).
12. French, J. A. et al. Long-term safety of adjunctive cenobamate in patients with uncontrolled focal seizures: Open-label extension of a randomized clinical study. Epilepsia 62, 2142–2150 (2021).
13. Ngugi, A. K., Bottomley, C., Kleinschmidt, I., Sander, J. W. & Newton, C. R. Estimation of the burden of active and life-time epilepsy: a meta-analytic approach. Epilepsia 51, 883–890 (2010).
14. Burneo, J. G., Tellez-Zenteno, J. & Wiebe, S. Understanding the burden of epilepsy in Latin America: a systematic review of its prevalence and incidence. Epilepsy Res. 66, 63–74 (2005).
15. Brodie, M. J., Barry, S. J. E., Bamagous, G. A., Norrie, J. D. & Kwan, P. Patterns of treatment response in newly diagnosed epilepsy. Neurology 78, 1548–1554 (2012).






















